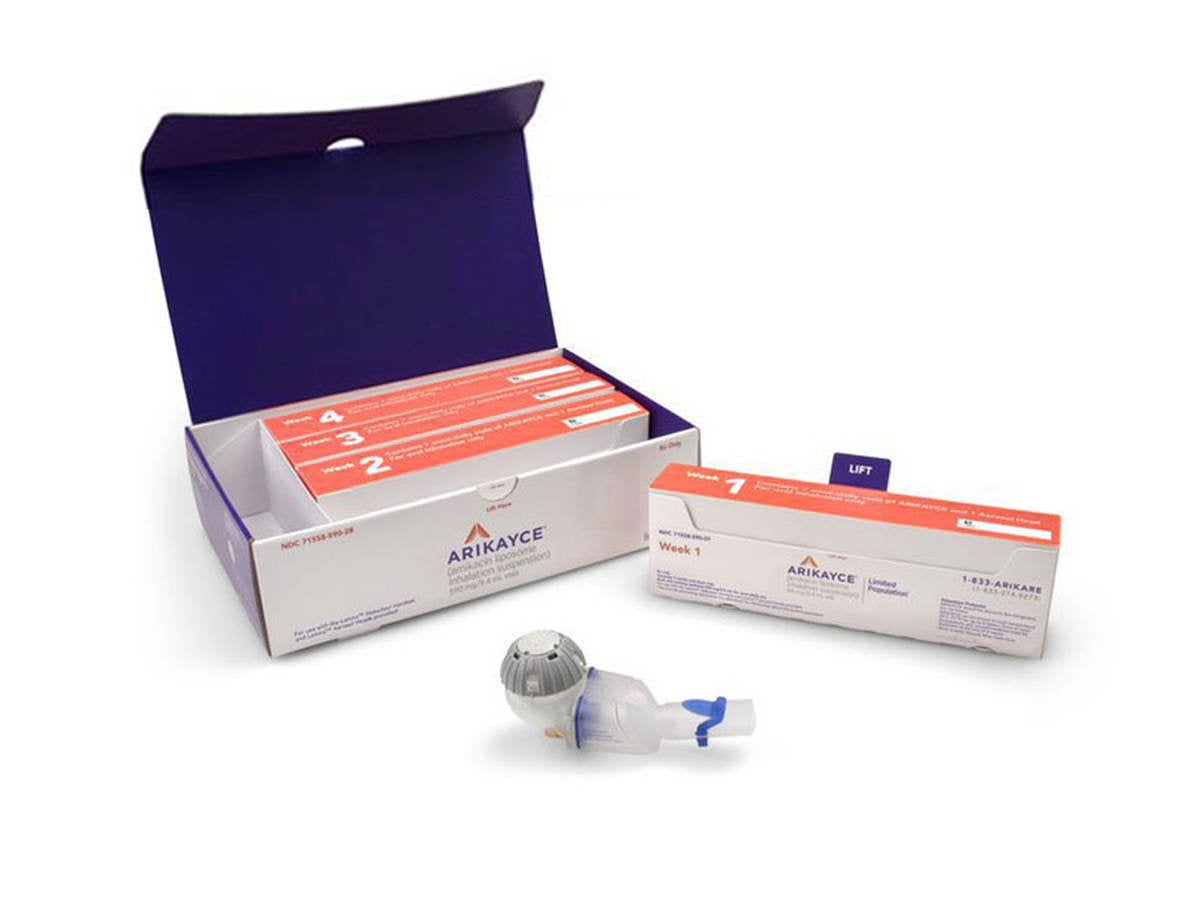
機器説明
アリケイス®(アミカシンリポソーム吸入用懸濁液剤) は、治療の選択肢がない、もしくは限られた治療しかできない成人の非結核性抗酸菌症(肺MAC症)患者向けに初めて承認された唯一の治療薬で、抗菌薬併用療法で使用されます。アリケイスは、PARI PharmaのeFlow®プラットフォームを基にしたラミラ®ネブライザーシステムを使用して、1日1回投与されます。
課題
米国食品医薬品局(FDA)にアリケイスの新薬申請(NDA)を提出する準備を進めていたインスメッドは、ラミラ®ネブライザーシステムの総括的評価を行い、ユーザビリティを最適なものにすることを決定しました。Emergo by ULは、この総括的評価を適切に設計し、スムーズに実施すること、また、必要な準備作業をすべて完了させることを支援しました。
ソリューション
インスメッドと密に連携して、使用に関するリスク分析を設計し、形成的評価と総括的評価を実施して、さらなるリスク軽減のアドバイスを提供しました。米国FDAとのディスカッションでは要求された総括的評価の様々な側面(例:ユーザグループ、サンプルサイズ、トレーニング)に関してサポートを提供しました。 最終的には、3つの異なるユーザーグループからトレーニングを受けたサンプルと受けていないサンプルを含む大規模な(N=92)総括的評価となり、そのデータがインスメッドのNDA申請に使用されました。
結果
インスメッドと緊密に協力しながら、Emergo by ULは幅広いHFEのタスクを実施し、インスメッドのNDA申請に使用する包括的で説得力のあるHFE/ユーザーエクスペリエンス(UE)レポートを作成しました。このサポートによりインスメッドは、FDAがラミラ®ネブライザーシステムの使用安全性を評価するために必要なデータを含めたNDA申請を期限内に提供することができました。アリケイスは2018年9月にFDAの承認を受けました。
Emergo by ULのエキスパートにご相談ください
お問い合わせありがとうございます。以下にご記入をお願いします。内容に応じて担当者が対応いたします。